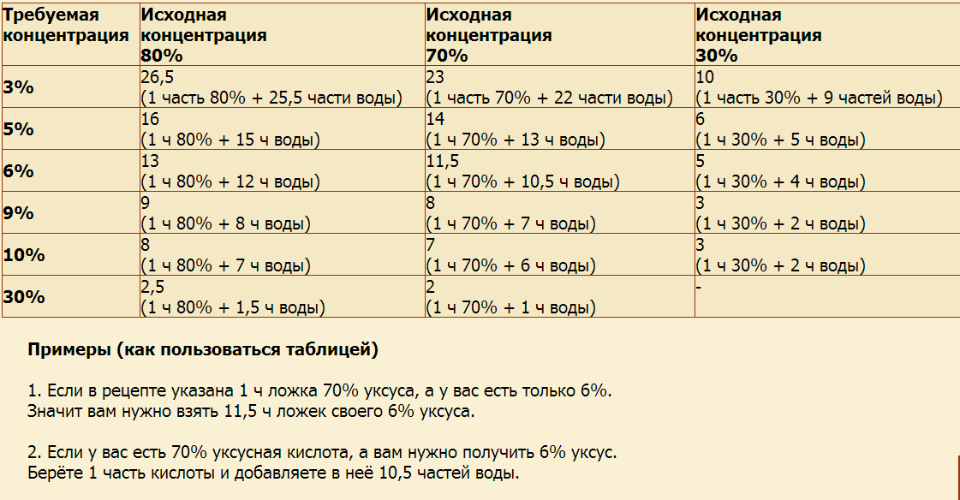
Уксусная кислота как развести до 9 процентного: Как сделать 9-процентный уксус из 70-процентной уксусной кислоты
Лаборатория 9 — Титрование
Назначение
Определить концентрацию уксусной кислоты в уксусе.
Цели
1
Провести кислотно-основное титрование.
2
Чтобы получить опыт осторожного титрования до видимой конечной точки.
3
Получить опыт наблюдения за титрованием с рН-электродом и определения точки эквивалентности.
4
Для расчета количества анализируемого вещества, присутствующего в результате титрования.
Введение
Многие лаборатории анализируют потребительские товары, чтобы определить точность маркировки продукта. В этом эксперименте демонстрируется очень распространенная и простая техника титрования .
Титрование — это аналитическая процедура, при которой реакция проводится в тщательно контролируемых условиях. Стехиометрический объем одного реагента известной концентрации, 9Измеряется титрант 0029 , необходимый для реакции с другим реагентом неизвестной концентрации, аналитом . Концентрацию аналита определяют по концентрации и объему титранта и стехиометрии реакции между ними.
Стехиометрический объем одного реагента известной концентрации, 9Измеряется титрант 0029 , необходимый для реакции с другим реагентом неизвестной концентрации, аналитом . Концентрацию аналита определяют по концентрации и объему титранта и стехиометрии реакции между ними.
Экспериментальная установка показана на рис. 1. Бюретка, содержащая титрант, откалибрована таким образом, чтобы объем выдаваемого ею раствора можно было определить с высокой точностью. Титрант добавляют к аналиту до тех пор, пока не будет добавлен стехиометрический объем титранта. Это называется точка эквивалентности, , в которой считывается объем титранта, поданный бюреткой. Обычно показания объема оцениваются с точностью до 0,01 мл. Подача титранта регулируется запорным краном на бюретке. С практикой можно дозировать доли капли титранта и контролировать процедуру достаточно хорошо, чтобы повторяющиеся титрования совпадали в пределах 0,10 мл. Для этой первой лаборатории вам потребуется, чтобы результаты титрования соответствовали погрешности в пределах 0,50 мл.
Рисунок 1 : Настройка титрования
Точка эквивалентности может быть определена двумя способами. pH можно контролировать во время титрования с помощью pH-электрода, и точка эквивалентности идентифицируется как точка наиболее быстрого изменения pH. Точку эквивалентности также можно определить визуально с помощью индикатора. В раствор анализируемого вещества добавляют индикатор, представляющий собой вещество, меняющее цвет вблизи точки эквивалентности. Поскольку изменение цвета близко, но не точно в точке эквивалентности, точка, в которой происходит изменение цвета, называется конечная точка. Индикаторы выбраны так, что конечная точка очень близка к точке эквивалентности.
Важно хорошо перемешивать титрование, чтобы титрант и аналит могли контактировать друг с другом и быстро реагировать. Можно использовать либо ручное завихрение стакана, либо механическое перемешивание. В этом эксперименте вы будете использовать механическое перемешивание.
Наиболее распространенным типом титрования является кислотно-основное титрование. В этом эксперименте вы определите концентрацию уксусной кислоты, НС 2 H 3 O 2 в техническом уксусе. Уксус представляет собой смесь уксусной кислоты и воды. В этом титровании водный раствор NaOH является титрантом, а уксус — аналитом. Считаем, что сильное основание и слабая кислота полностью реагируют по суммарному уравнению:
(1)
HC 2 H 3 O 2 (AQ) + OH — (AQ) → C 2 H 3 O 2 — (AQ) + H 2 — (AQ) + H 2 O (L O (L O (AQ) + H 2 O (AQ) + H 2 O (AQ) + H 2 O (AQ) + H 2 9. )
Сбалансированное уравнение показывает стехиометрию 1:1, поэтому мы можем написать:
( 2 )
моли HC 2 H 3 O 2 реагирующие = моли OH – добавленные
Или в более общем плане:
(3)
моль реагирующей кислоты = моль реагирующего основания
Моли основания можно рассчитать путем умножения концентрации основания на объем используемого основания (моль база = M база × V база ). Напомним о единицах концентрации: молярность определяется как количество молей растворенного вещества в литре раствора (М = моль/л). Это численно равно количеству миллимолей растворенного вещества в миллилитре раствора (M = ммоль/мл). Часто бывает удобно использовать это второе определение молярности при титровании и других работах, связанных с малыми количествами. В 1 моль содержится 1000 ммоль, а в 1 литре 1000 мл.
Напомним о единицах концентрации: молярность определяется как количество молей растворенного вещества в литре раствора (М = моль/л). Это численно равно количеству миллимолей растворенного вещества в миллилитре раствора (M = ммоль/мл). Часто бывает удобно использовать это второе определение молярности при титровании и других работах, связанных с малыми количествами. В 1 моль содержится 1000 ммоль, а в 1 литре 1000 мл.
Например, 10,2 мл 0,100 М раствора NaOH содержат 1,02 ммоль NaOH.
( 4 )
10,2 мл раствора ×
| 0,100 ммоль NaOH |
| 1 мл раствора |
= 1,02 ммоль
4 NaOH
5
Молярность уксусной кислоты в уксусе может быть рассчитана путем деления молей уксусной кислоты на объем аналита
(M кислоты = моли кислоты / V аналита )
. Используя приведенные выше значения, если для титрования требуется 1,02 ммоль NaOH для достижения конечной точки, образец также должен содержать 1,02 ммоль уксусной кислоты. Если объем используемого уксуса составляет 8,05 мл, молярность уксусной кислоты составляет 1,02 ммоль/8,05 мл = 0,127 М.
Если объем используемого уксуса составляет 8,05 мл, молярность уксусной кислоты составляет 1,02 ммоль/8,05 мл = 0,127 М.
В этом эксперименте тщательно измеренный объем уксуса (V аналит ) помещают в химический стакан и определяют массу. Затем образец уксуса титруют раствором NaOH известной концентрации (M , основание ) и определяют объем раствора NaOH, необходимый для достижения конечной точки (V , основание ). V основание , M основание и V аналит все известны, поэтому концентрацию кислоты (M кислота ) можно определить, как описано выше. Кроме того, массу уксусной кислоты в образце можно определить по количеству присутствующих молей и молярной массе уксусной кислоты (г кислоты = MW кислоты x моль кислоты ). Наконец, массовый процент уксусной кислоты в уксусе можно определить по массе уксусной кислоты в образце и массе титруемого раствора уксуса (аналита).
( 5 )
% масс.
При титровании уксусной кислоты водным раствором NaOH в качестве индикатора используют фенолфталеин. Фенолфталеин почти бесцветен в кислом растворе, но становится розовым при рН около 8. Это указывает на то, что основание нейтрализовало всю кислоту. При титровании уксуса вы заметите, что розовый цвет становится более стойким, если вы добавляете больше основания. Это сигнал замедлить добавление основания и тщательно контролировать его. Конечная точка была достигнута, когда слабая розовая окраска сохраняется не менее 30 секунд. Промахнуться за конечную точку легко. Если это произойдет, у вас будет темно-фиолетово-розовый раствор, и вам придется повторить титрование, поэтому будьте осторожны. Обратите внимание на объем, который вы использовали; при последующих титрованиях останавливайтесь, не достигнув этого объема, и добавляйте последний миллилитр или около того по каплям. Ваш инструктор покажет вам, как управлять запорным краном бюретки, чтобы облегчить это.
Обратите внимание, что измерения объема при титровании обычно сообщают до четыре значащих цифры, , поэтому концентрации обычно также указываются с четырьмя значащими цифрами. Наблюдайте за этим в своей работе; когда вы вычисляете молярные массы, убедитесь, что у вас есть четыре значащие цифры.
Наблюдайте за этим в своей работе; когда вы вычисляете молярные массы, убедитесь, что у вас есть четыре значащие цифры.
Оборудование
1
Интерфейс Микролаб
1
Инструкции по измерению pH MicroLab
1
pH-электрод в буфере pH 7,00
1
Мерный цилиндр на 10,0 мл
1
стакан 30 мл
1
стакан 100 мл
2
стаканы 250 мл
1
бюретка на 25 мл
1
кольцевая подставка
1
зажим
1
зажим для бюретки
1
магнитная мешалка
1
магнитная мешалка
1
бутылка с деионизированной водой
1
коробка Kimwipes
Реагенты
~ 50 мл 0,5 М гидроксида натрия (NaOH)
технический уксус (HC 2 H 3 O 2 )
буфер pH 4,00
буфер pH 7,00
буфер pH 10,00
раствор фенолфталеина
деионизированная вода
Безопасность
NaOH вызывает коррозию. Он может атаковать кожу и вызвать необратимое повреждение глаз. Если раствор NaOH попал вам в глаза, немедленно используйте жидкость для промывания глаз. Держите глаза открытыми и промойте их водой. При попадании на кожу или одежду промойте пораженный участок водой. Попросите партнера по лаборатории сообщить инструктору о разливе.
Он может атаковать кожу и вызвать необратимое повреждение глаз. Если раствор NaOH попал вам в глаза, немедленно используйте жидкость для промывания глаз. Держите глаза открытыми и промойте их водой. При попадании на кожу или одежду промойте пораженный участок водой. Попросите партнера по лаборатории сообщить инструктору о разливе.
Химические вещества, используемые в этом эксперименте, очень разбавлены, поэтому перчатки не будут доступны. Не забудьте вымыть руки водой с мылом, когда эксперимент будет завершен.
Удаление отходов
Все растворы можно смывать в раковину большим количеством воды.
До класса
Пожалуйста, прочтите следующие разделы вводного материала:
Аналитические весы
Объемная посуда
Измерения
Пожалуйста, просмотрите следующие видео:
Очистка, кондиционирование и наполнение бюретки
Выполнение титрования
Чистка и хранение бюретки
Пожалуйста, выполните предварительное задание WebAssign. Проверьте сроки выполнения в своей учетной записи WebAssign. Учащиеся, не выполнившие предварительное лабораторное задание WebAssign, должны принести и сдать лист предварительной лабораторной работы.
Проверьте сроки выполнения в своей учетной записи WebAssign. Учащиеся, не выполнившие предварительное лабораторное задание WebAssign, должны принести и сдать лист предварительной лабораторной работы.
Лабораторная процедура
Пожалуйста, распечатайте рабочий лист для этой лабораторной работы. Этот лист понадобится вам для записи ваших данных.
В этом эксперименте вы будете использовать рН-электроды, подключенные к интерфейсу MicroLab. Электроды pH имеют тонкую стеклянную колбу на конце. Они легко ломаются и требуют больших затрат на замену. Будьте осторожны, чтобы не толкнуть электрод на дно стакана и не уронить электрод. Вокруг наконечника имеется защитный кожух, который всегда должен оставаться на месте. Гарда не защитит от небрежного обращения. Пожалуйста, будьте предельно осторожны при использовании этого оборудования.
Наилучшие результаты использования электродов достигаются, если:
•
Когда электроды не используются, их хранят в стандартном буферном растворе с pH 7.

•
Непосредственно перед использованием электроды промывают деионизированной водой и осторожно промокают салфеткой, а затем помещают в испытуемый раствор.
•
Электроды промывают и снова промокают после измерения и возвращают в буферный раствор с pH 7.
Часть A: Калибровка pH-электрода MicroLab
1
Откройте программу МикроЛаб.
2
Убедитесь, что pH-электрод подключен к интерфейсу.
3
Откалибруйте pH-электрод, используя инструкции MicroLab, предоставленные в лаборатории.
4
Настройте программу MicroLab, используя прилагаемую инструкцию.
5
После завершения калибровки и настройки измерьте pH каждого из трех буферных растворов: pH = 4,00 (красный), pH = 7,00 (желтый) и pH = 10,00 (синий). Запишите значение на цифровом дисплее в WebAssign как запись того, насколько точно датчик откалиброван.
 Убедитесь, что электрод погружен в раствор, и подождите несколько секунд, пока он не уравновесится.
Убедитесь, что электрод погружен в раствор, и подождите несколько секунд, пока он не уравновесится.
Часть B: Титрование уксуса под контролем pH-зонда и индикатора
1
Возьмите чистый, сухой градуированный цилиндр объемом 10,0 мл.
2
Используя чистую сухую мензурку на 30 мл, наберите около 25 мл уксуса.
3
Обработайте градуированный цилиндр раствором уксуса перед использованием. Это делается путем добавления небольшого количества раствора уксуса в градуированный цилиндр, завихрения, чтобы все стороны были покрыты уксусом, а затем сливанием оставшегося уксуса. Повторите эту процедуру еще 1–2 раза, чтобы убедиться, что мерный цилиндр кондиционирован.
4
Измерьте массу пустого стакана на 250 мл и запишите это значение в Таблицу данных А1. С помощью мерного цилиндра на 10,0 мл перелейте в химический стакан 7,0 мл уксуса. Взвесьте химический стакан и уксус вместе и запишите массу в Таблицу данных A1.
 Также запишите объем уксуса в Таблицу данных A1.
Также запишите объем уксуса в Таблицу данных A1.5
Добавьте ~ 40 мл деионизированной воды (не используйте для этого градуированный цилиндр, так как он подготовлен для уксуса!) и 3 капли раствора фенолфталеина в химический стакан, содержащий уксус.
6
Получите около 50 мл ~ 0,5 М раствора NaOH в чистую сухую мензурку на 100 мл. Запишите точную концентрацию из бутылки NaOH в Таблицу данных A1.
7
Обработайте бюретку на 25,0 мл раствором NaOH в соответствии с указаниями инструктора и в соответствии с описанием в разделе «Объемная посуда» раздела «Лабораторное оборудование».
8
Наполните бюретку раствором NaOH и осторожно закрепите ее на кольцевом штативе. Не забудьте заполнить наконечник раствором NaOH, слив немного раствора из наконечника в стакан для отходов. Для этого эксперимента объемы титрования будет легче ввести в программное обеспечение MicroLab, если начальный объем NaOH будет ТОЧНО 0,00 мл.

9
Аккуратно вставьте мешалку в стакан на 250 мл с раствором уксуса, наклонив его, чтобы избежать разбрызгивания или повреждения стакана. Поместите мешалку под стакан на 250 мл и начните медленно помешивать.
10
Аккуратно поместите рН-электрод в 250-мл прерыватель так, чтобы примерно 1/2 дюйма наконечника оказались в растворе. Закрепите на кольцевой стойке с помощью прилагаемого зажима. Убедитесь, что мешалка не ударит по pH-электроду. При необходимости добавьте еще воды. См. Рисунок 2 для полной настройки.
Рис. 2 : Экспериментальная установка
11
Расположите бюретку так, чтобы кончик бюретки находился внутри стакана. См. рис. 2.
12
Снимите начальные показания pH, введя начальные показания бюретки в окне программного обеспечения MicroLab и нажав кнопку возврата. Вы также должны записать все свои данные в таблицу данных B на случай, если что-то пойдет не так с компьютером.
 Не забудьте прочитать бюретку с точностью до 0,01 мл . Читать бюретку с такой точностью сложно; ожидается, что последняя значащая цифра будет оценочной.
Не забудьте прочитать бюретку с точностью до 0,01 мл . Читать бюретку с такой точностью сложно; ожидается, что последняя значащая цифра будет оценочной.
Рисунок 3 : Таблица данных B: Объем титранта, добавленного к уксусу, в зависимости от pH
13
Откройте кран бюретки и добавьте ~2,0 мл титранта (NaOH) к содержимому стакана (HC 2 H 3 O 2 + вода + индикатор). Перемешивайте около 10 секунд. Затем прочтите точный объем на бюретке, введите это значение в программное обеспечение MicroLab и снимите показания pH. Не забудьте записать свои измерения в таблицу данных B.
14
Продолжайте добавлять титрант с шагом ~2,0 мл и запишите объем бюретки и pH в таблице данных B. Остановитесь на уровне ~8,0 мл объема титранта.
15
После добавления ~8,0 мл титранта приращение добавления титранта следует уменьшать по мере приближения к конечной точке.
 Добавляйте титрант порциями ~1,0 мл, пока не будет добавлено в общей сложности ~11 мл титранта. Затем уменьшите количество добавляемого титранта с шагом ~0,5 мл или меньше. В этот момент pH должен измениться более чем на 0,3 единицы pH за одно добавление, сигнализируя о конечной точке титрования. Вы также увидите появление бледно-розового цвета, который быстро исчезнет. Когда окраска начнет исчезать медленнее, медленно добавляйте титрант до скорости по каплям. Промойте стенки стакана и кончик бюретки деионизированной водой из промывной бутылки по мере приближения к конечной точке. Это гарантирует, что весь NaOH, доставленный из бюретки, попадет в реакционную смесь. Конечная точка достигается, когда бледно-розовый цвет сохраняется не менее 30 секунд . Запишите показание точки эквивалентности на бюретке с точностью до 0,01 мл в таблице данных A1.
Добавляйте титрант порциями ~1,0 мл, пока не будет добавлено в общей сложности ~11 мл титранта. Затем уменьшите количество добавляемого титранта с шагом ~0,5 мл или меньше. В этот момент pH должен измениться более чем на 0,3 единицы pH за одно добавление, сигнализируя о конечной точке титрования. Вы также увидите появление бледно-розового цвета, который быстро исчезнет. Когда окраска начнет исчезать медленнее, медленно добавляйте титрант до скорости по каплям. Промойте стенки стакана и кончик бюретки деионизированной водой из промывной бутылки по мере приближения к конечной точке. Это гарантирует, что весь NaOH, доставленный из бюретки, попадет в реакционную смесь. Конечная точка достигается, когда бледно-розовый цвет сохраняется не менее 30 секунд . Запишите показание точки эквивалентности на бюретке с точностью до 0,01 мл в таблице данных A1.16
Чтобы закончить построение кривой титрования, возвращайтесь к приращениям титранта по 1 мл по мере того, как изменения pH уменьшаются ниже 0,3 единицы pH за пределами точки эквивалентности.
 Не останавливайте титрование до тех пор, пока не будет добавлено примерно 5 мл титранта сверх точки эквивалентности.
Не останавливайте титрование до тех пор, пока не будет добавлено примерно 5 мл титранта сверх точки эквивалентности.17
Когда вы закончите титрование, остановите программу сбора данных MicroLab. Аккуратно извлеките pH-электрод из раствора, промойте его и поместите в буфер pH 7.
18
Просмотрите график, созданный программой титрования MicroLab, чтобы определить объем бюретки, при котором скорость изменения pH максимальна, а наклон линии для мл титранта в зависимости от pH близок к вертикальному. Это будет ваше показание бюретки для точки эквивалентности в таблице данных A1.
Следующие таблицы расположены на дополнительном листе.
Таблица данных A1: Экспериментальные данные
Таблица данных A2: Расчетные результаты
Таблица данных B: Объем титранта, добавленного к уксусу, в зависимости от pH
Вопрос 1: Кривая титрования слабой кислоты, такой как уксусная кислота, основанием имеет характерный вид, когда объем титранта отложен по оси x , а pH отложен по оси y .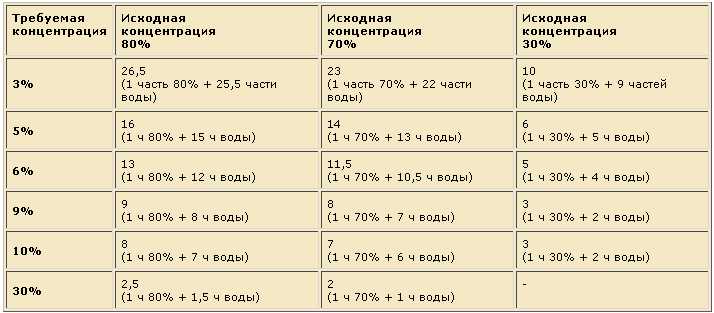 Выберите картинку, которая больше всего похожа на этот график.
Выберите картинку, которая больше всего похожа на этот график.
Рисунок 4
Вопрос 2: Какого цвета раствор при pH ниже 8? Какого цвета раствор при рН выше 8? Найдите pH 8,00 на графике титрования. Насколько близко количество титранта при pH 8,00 к показаниям Бюретки точки эквивалентности? В пределах 0,50 мл? В пределах 1,00 мл?
Часть C: Титрование уксуса под контролем индикатора фенолфталеина
1
Удалите зонд pH из раствора и верните его в буфер pH 7. Мониторинг pH и ввод с клавиатуры объема не требуется для этой части эксперимента.
2
Снова наполните бюретку NaOH и осторожно закрепите ее на кольцевой подставке.
3
Запишите начальное показание на бюретке с точностью до 0,01 мл в таблице данных A1. Считать бюретку с такой точностью сложно. Помните, что последняя значащая цифра должна быть оценочной.

4
Измерьте массу пустого стакана на 250 мл и запишите это значение в Таблицу данных А1. Используя градуированный цилиндр на 10,0 мл, перенесите в колбу 7,0 мл уксуса. Взвесьте колбу и уксус вместе и запишите массу в Таблицу данных А1. Также запишите объем уксуса в Таблицу данных C.
5
Добавьте ~ 40 мл деионизированной воды (не используйте для этого градуированный цилиндр, так как он подготовлен для уксуса!) и 3 капли раствора фенолфталеина в химический стакан, содержащий уксус.
6
Откройте кран бюретки и добавьте немного титранта (NaOH) к содержимому колбы (HC 2 H 3 O 2 + вода + индикатор). Подождите примерно 10-30 секунд, пока раствор перемешается.
7
Продолжайте медленно добавлять титрант. По мере добавления вы увидите, как появляется слабый розовый цвет, который быстро исчезает. Когда окраска начнет исчезать медленнее, медленно добавляйте титрант до скорости по каплям.
 Промойте стенки стакана и кончик бюретки деионизированной водой из промывной бутылки по мере приближения к конечной точке. Это гарантирует, что весь NaOH, доставленный из бюретки, попадет в реакционную смесь. Конечная точка достигается, когда бледно-розовый цвет сохраняется не менее 30 секунд. Запишите окончательное показание на бюретке с точностью до 0,01 мл в таблице данных A1.
Промойте стенки стакана и кончик бюретки деионизированной водой из промывной бутылки по мере приближения к конечной точке. Это гарантирует, что весь NaOH, доставленный из бюретки, попадет в реакционную смесь. Конечная точка достигается, когда бледно-розовый цвет сохраняется не менее 30 секунд. Запишите окончательное показание на бюретке с точностью до 0,01 мл в таблице данных A1.8
Когда закончите, слейте оставшийся NaOH из бюретки в химический стакан на 100 мл. Вылейте все растворы в раковину с большим количеством воды.
9
Промойте всю стеклянную посуду водой, высушите ее и верните в место установки, где вы ее нашли. Закройте программу МикроЛаб.
Вопрос 3: Рассчитайте количество миллимолей NaOH, необходимое для достижения конечной точки каждого титрования. Покажите один расчет полностью. Каково среднее значение? Запишите значения в Таблицу данных A2.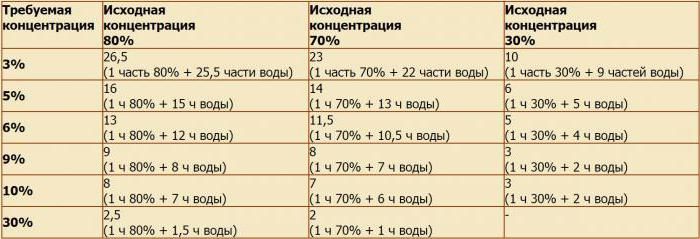
Вопрос 4: Сколько миллимолей уксусной кислоты содержится в каждом образце уксуса? Покажите один расчет полностью. Каково среднее значение? Запишите значения в Таблицу данных A2.
Вопрос 5: Какова масса уксусной кислоты в каждом образце уксуса? Покажите один расчет полностью. Каково среднее значение? Запишите значения в Таблицу данных A2.
Вопрос 6: Какова молярность уксусной кислоты в каждом образце уксуса? Покажите один расчет полностью. Каково среднее значение? Запишите значения в Таблицу данных A2.
Вопрос 7: Какова массовая доля уксусной кислоты в каждом образце уксуса? Покажите один расчет полностью. Каково среднее значение? Запишите значения в Таблицу данных A2.
Таблица данных A2: Расчетные результаты
Вопрос 8: Вы предпочитаете контролировать титрование с помощью рН-зонда или индикатора? Объяснить ваш выбор.
10
Перед уходом подойдите к компьютеру в лаборатории и введите свои результаты в лабораторном задании. Если все результаты признаны правильными, выйдите из системы. Если не все результаты верны, попробуйте найти ошибку или проконсультируйтесь с лаборантом. Если все результаты правильные, запишите их и выйдите из WebAssign. Лабораторное задание должно быть выполнено к концу лабораторного периода. Если требуется дополнительное время, проконсультируйтесь с преподавателем лаборатории.
рН после разбавления слабой кислоты Учебное пособие по химии
Пожалуйста, не блокируйте рекламу на этом веб-сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Сравнение концентрированных и разбавленных растворов слабой кислоты
Уксусная кислота (этановая кислота), CH 3 COOH, является слабой кислотой, она лишь частично диссоциирует в воде, поэтому недиссоциированные (неионизированные) молекулы уксусной кислоты находятся в равновесии с ионами водорода (протонами или гидронами), H + (водн. ) и ионы ацетата (ионы этаноата), CH 3 COO — (водн.) , как показано химическим уравнением, приведенным ниже:
) и ионы ацетата (ионы этаноата), CH 3 COO — (водн.) , как показано химическим уравнением, приведенным ниже:
| Диссоциация уксусной кислоты (ионизация этановой кислоты) | |||||
|---|---|---|---|---|---|
| Словесное уравнение: | уксусная кислота (этановая кислота) | ⇋ | ионы водорода (протоны или гидроны) | + | ионы ацетата (ионы этаноата) |
| Сбалансированное химическое уравнение: | СН 3 СООН | ⇋ | H + (водный) | + | CH 3 COO — (водный) |
Представьте, что у вас есть два флакона с реагентами, флакон A и флакон B, содержащие разные концентрации уксусной кислоты, CH 3 COOH (водный) , оба при 25°C и 1 атм.
Флакон А содержит 0,100 моль л -1 CH 3 COOH (водный) с pH 2,87
Флакон B содержит 0,010 моль л -1 CH 3 COOH (водный) с pH 3,37
Давайте сравним эти две бутылки уксусной кислоты.
Флакон А содержит более концентрированный раствор уксусной кислоты, чем Флакон В.
| Бутыль А | Бутыль А | ||
|---|---|---|---|
| [CH 3 COOH (водный) ] (моль л -1 ) | 0,100 моль | > | 0,010 |
| относительная концентрация | более концентрированный | более разбавленный |
Обратите внимание, что рН более концентрированного раствора уксусной кислоты в бутылке А ниже.
| Бутыль А | Бутыль А | ||
|---|---|---|---|
| [CH 3 COOH (водн.) ] (моль л -1 ) | 0,100 | > | 0,010 |
| относительная концентрация | более концентрированный | более разбавленный | |
| рН | 2,87 | < | 3,37 |
| относительный рН | нижний | выше |
Что говорит нам о том, что концентрация ионов водорода [H + (водн. ) ] в бутылке A должна быть больше, чем в бутылке B:
) ] в бутылке A должна быть больше, чем в бутылке B:
| Бутыль А | Бутыль А | ||
|---|---|---|---|
| [CH 3 COOH (водн.) ] (моль л -1 ) | 0,100 | > | 0,010 |
| относительная концентрация | более концентрированный | более разбавленный | |
| рН | 2,87 | < | 3,37 |
| относительный рН | нижний | выше | |
| [H + (водн.) ] = 10 -pH (моль л -1 ) | 1,35 × 10 -3 | > | 4,27 × 10 -4 |
| относительный [H + (водный) ] | выше | нижний |
Мы также можем рассчитать % диссоциации (% ионизации) для раствора уксусной кислоты в каждой бутыли и сравнить результаты:
| Бутыль А | Бутыль А | ||
|---|---|---|---|
| [CH 3 COOH (водный) ] (моль л -1 ) | 0,100 | > | 0,010 |
| относительная концентрация | более концентрированный | более разбавленный | |
| рН | 2,87 | < | 3,37 |
| относительный рН | нижний | выше | |
[H + (водн. ) ] = 10 -pH (моль л -1 ) ) ] = 10 -pH (моль л -1 ) | 1,35 × 10 -3 | > | 4,27 × 10 -4 |
| относительный [H + (водный) ] | выше | нижний | |
| % диссоциации = ([H + (водн.) ]/[CH 3 COOH (водн.) ]) × 100 | 1,35% | < | 4,27% |
| относительный % диссоциации | меньше | больше |
, и мы находим, что % диссоциации уксусной кислоты в более разбавленном растворе (бутылка B) больше, чем в более концентрированном растворе (бутылка A).
Этот повышенный % диссоциации слабой кислоты при разбавлении можно предсказать с помощью принципа Ле Шателье.
Перед разбавлением молекулы недиссоциированной уксусной кислоты в растворе находились в равновесии с ионами водорода и ацетат-ионами, как показано ниже:
| растворенное вещество | + | растворитель | ⇋ | решение | ||
|---|---|---|---|---|---|---|
| уксусная кислота | + | вода | ⇋ | ионы водорода | + | ионы ацетата |
| CH 3 COOH (водный) | + | Н 2 О (л) | ⇋ | H 3 O + (водный) | + | CH 3 COO — (водный) |
Когда мы разбавляем раствор, добавляя больше воды, мы нарушаем (или нарушаем) это равновесие.
Равновесие смещается вправо, потребляя больше молекул CH 3 COOH (водн.) для производства большего количества H 3 O + (водн.) (или H + (водн.) ) и более CH 3 COO — (водный) .
Следовательно, количество молекул CH 3 COOH (водн.) уменьшается, а количество ионов H 3 O + (водн.) (или H + (водн.) ) увеличивается.
Таким образом, % диссоциации (% ионизации) кислоты увеличивается после разбавления.
Но помните, хотя число ионов водорода увеличилось, объем раствора после разбавления увеличился еще больше.
Небольшое увеличение молей H + (водн.) , большее увеличение объема раствора.
Итак, концентрация водородных ионов в растворе, моль водородных ионов на литр раствора, после разбавления уменьшилась.
При разбавлении водного раствора слабой кислоты при 25°C и 1 атм важно помнить, что ПОСЛЕ разбавления полученный раствор имеет:
- более низкая концентрация кислоты
- более низкая концентрация ионов водорода
- более высокий уровень pH
- более высокий % диссоциации (% ионизации)
Теперь мы готовы выполнить расчеты для определения pH водного раствора слабой кислоты после его разбавления добавлением большего количества воды.
Расчет pH водного раствора слабой кислоты после разбавления
В приведенном выше примере бутыль А содержала более концентрированный раствор уксусной кислоты, чем бутыль Б.
Флакон А : 0,100 моль л -1 раствор уксусной кислоты, CH 3 COOH (водный) , с pH 2,87 (25°C, 1 атм.).
Флакон А: 0,010 моль л -1 раствор уксусной кислоты, CH 3 COOH (водный) , с pH 3,37 (25°C, 1 атм.).
Если мы хотим приготовить более разбавленный раствор уксусной кислоты в бутылке B, у нас есть несколько вариантов.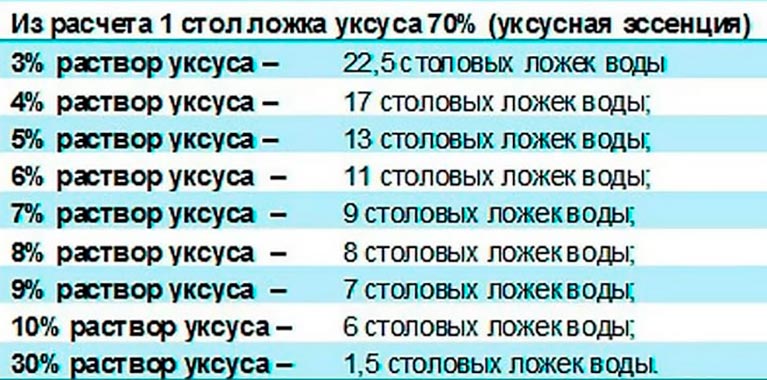 Например, мы могли бы:
Например, мы могли бы:
- растворить 0,010 моль уксусной кислоты в воде, достаточном для получения 1 л водного раствора, [CH 3 COOH (водн.) ] = 0,010 моль л -1
- разбавьте 10 мл 0,100 моль раствора L -1 в бутылке A достаточным количеством воды, чтобы получить 100,0 мл раствора (разведение 1 к 10 или разведение в 10 раз), [CH 3 COOH (водн.) ] = 0,010 моль л -1
Хотя каждый раствор 0,010 моль л -1 CH 3 COOH (водн.) будет приготовлен по-разному, оба они будут иметь:
- то же [CH 3 COOH (водный) ]
- то же [CH 3 COO — (водный) ]
- то же [H + (водный) ]
- то же K a (константа диссоциации кислоты)
- то же % диссоциации (% ионизации)
- тот же pH
Однако, когда количество растворенного вещества, которое нам нужно растворить, становится слишком маленьким для точного измерения или объем раствора становится слишком большим для точного измерения, мы предпочитаем готовить более концентрированный раствор, а затем разбавлять его до нужной концентрации. желаемая концентрация.
желаемая концентрация.
Итак, посчитаем рН раствора уксусной кислоты после разбавления.
Сначала пипеткой отбирают 10,00 мл 0,100 моль раствора L -1 уксусной кислоты в мерную колбу вместимостью 100,00 мл, затем добавляют дистиллированной воды до метки.
Нам потребуется найти концентрацию уксусной кислоты в полученном растворе (раствор после разбавления).
Мы можем использовать «формулу разбавления», чтобы вычислить это:
с 1 В 1 = с 2 В 2
c 1 = [CH 3 COOH (водн.) (перенесено) ] = 0,100 моль л -1
V 1 = V (перенесено) = 10,00 мл = 10,00 мл ÷ 1000 мл /л = 0,0100 л
c 2 = [CH 3 COOH (водн.) (результат) ] = ? моль л -1
V 2 = V (результат) = 100,00 мл = 100,00 мл ÷ 1000 мл /л = 0,100 л
Подставить известные значения в уравнение:
с 1 В 1 = с 2 В 2
0,100 × 0,0100 = с 2 × 0,100
0,00100 = с 2 × 0,100
Разделите обе части уравнения на 0,100
0,00100 ÷ 0,100 = (c 2 × 0,100 ) ÷ 0,100
0,0100 моль л -1 = с 2
Концентрация уксусной кислоты в полученном растворе (раствор после разбавления) 0,0100 моль л -1
Но какова концентрация ионов водорода, c(H + (водн. ) ) в полученном растворе?
) ) в полученном растворе?
Уксусная кислота является слабой кислотой, она лишь частично диссоциирует, как показано в приведенном ниже химическом уравнении:
CH 3 COOH (водн.) ⇋ H + (водн.) + CH 3 COO — (водн.)
, поэтому концентрация H + (водн.) в растворе будет меньше концентрации молекулярной уксусной кислоты CH 3 COOH (водн.) .
Но насколько меньше?
Мы должны начать с записи выражения закона равновесия для этой диссоциации, уравнения для константы кислотной диссоциации (K и ):
| К и | = | [H + (водн.) ][CH 3 COO — (водн.) ] [CH 3 4 90a COOH 900 900 |
Если вы посмотрите таблицу констант кислотной диссоциации (значения K a ), вы найдете K a = 1,8 × 10 -5 для диссоциации уксусной кислоты при 25°С.
| К и | = | [H + (водн.) ][CH 3 COO — (водн.) ] [CH 3 4 90a COOH 900 900 | = | 1,8 × 10 -5 |
Пусть x представляет собой количество CH 3 COOH (водн.) , которое диссоциирует.
Итак, после диссоциации [CH 3 COOH (водн.) ] = 0,0100 — x
Поскольку стехиометрическое соотношение (молярное отношение) CH 3 COOH к H + и CH 3 COO — составляет 1:1:1 (из сбалансированного химического уравнения диссоциации), мы можем сказать, что [H + (водн.) ] = [CH 3 COO — (водный) ] = x
Теперь мы можем подставить эти значения в уравнение для K a :
| [H + (AQ) ] [Ch 3 COO — (AQ) ] [Ch 3 COOH (AQ) [Ch 3 (AQ) [Ch 3 (AQ) [CH 3 (AQ) = | 1,8 × 10 -5 | |
| [ x ] [ x ] [0,0100 — x ] | = | 1,8 × 10 -5 |
| [ x ] 2 [0,0100 — x ] | = | 1,8 × 10 -5 |
| [ x ] 2 | = | 1,8 × 10 -5 [0,0100 — x ] |
| [ x ] 2 | = | 1,8 × 10 -7 — 1,8 × 10 -5 x |
| [ x ] 2 + 1,8 × 10 -5 x — 1,8 × 10 -7 | = | 0 |
К сожалению, нам пришлось бы решать это квадратное уравнение, если бы мы хотели определить значение x .
Однако, поскольку значение K a невелико, мы знаем, что небольшое количество молекулярной уксусной кислоты диссоциирует, поэтому x должно быть мало по сравнению с концентрацией уксусной кислоты, и в этом случае:
0,0100 — x &прибл. 0,0100
, поэтому мы можем использовать это приближение в нашем уравнении выше:
| [H + (AQ) ] [Ch 3 COO — (AQ) ] [Ch 3 COOH (AQ) [Ch 3 (AQ) [Ch 3 (AQ) [CH 3 (AQ) = | 1,8 × 10 -5 | |
| [ x ] [ x ] [0,0100 — x ] | = | 1,8 × 10 -5 |
| [ x ] 2 [0,0100 — x ] | = | 1,8 × 10 -5 |
допустим 0,0100 — x &прибл.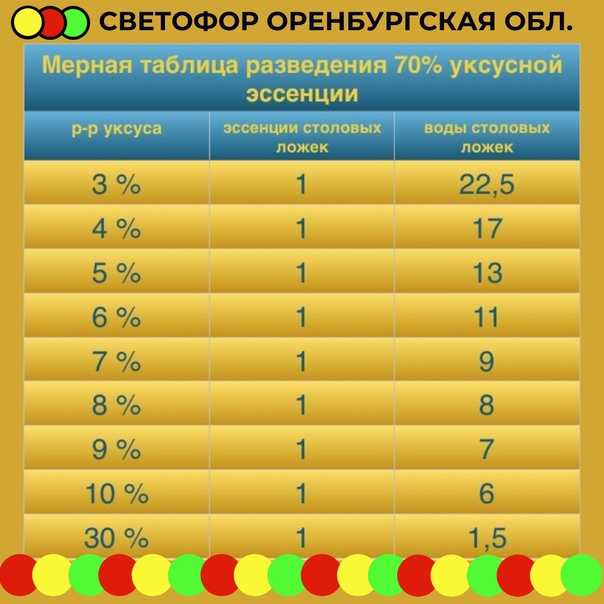 0,0100 0,0100 | ||
| [ x ] 2 [0,0100] | &прибл. | 1,8 × 10 -5 |
Умножить обе части уравнения на 0,0100
| [ | &прибл. | 0,0100 × 1,8 × 10 -5 |
| [ x ] 2 | &прибл. | 1,8 × 10 -7 |
Возьмите квадратный корень из обеих частей уравнения, чтобы найти значение x :
| √[ x ] 2 | &прибл. | √(1,8 × 10 -7 ) |
| х | &прибл. | 4,24 × 10 -4 |
Поскольку [H + (водн.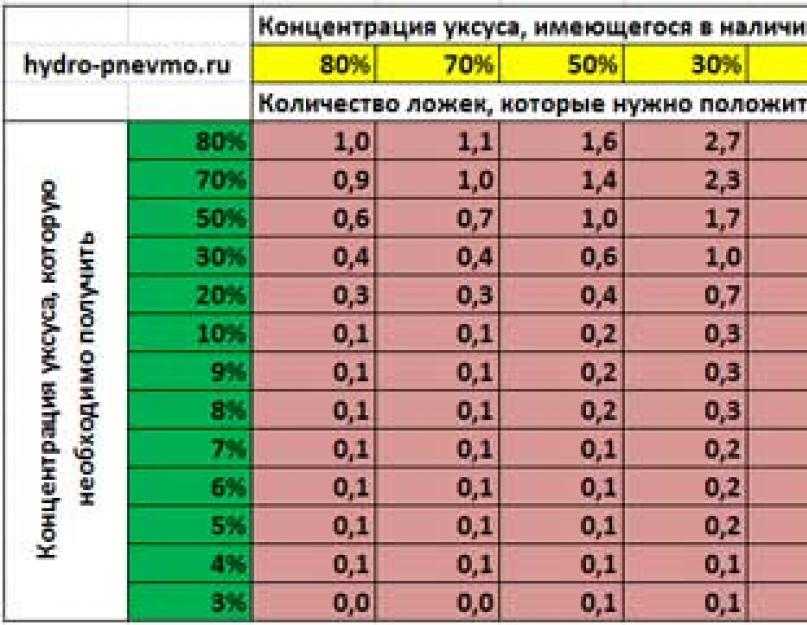 ) (результирующий раствор) ] = x
) (результирующий раствор) ] = x
теперь мы знаем концентрацию ионов водорода в полученном растворе:
[H + (водн.) (результирующий раствор) ] = x = 4,24 × 10 -4 моль л -1
Зная концентрацию ионов водорода в растворе, мы можем рассчитать pH раствора:
pH = -log 10 [H + (водн.) (результирующий раствор) ] = -log 10 [4,24 × 10 -4 ] = 3,37
Просто предостережение, прежде чем мы двинемся дальше.
Если раствор уксусной кислоты станет очень разбавленным и концентрация уксусной кислоты станет очень маленькой, скажем, 10 -12 моль л -1 , вы получите глупые результаты, используя этот метод расчета!
Позвольте мне показать вам…
| [ x ] 2 10 -12 | &прибл. | 1,8 × 10 -5 |
| [ x ] 2 | &прибл. | 10 -12 × 1,8 × 10 -5 |
| [ x ] 2 | &прибл. | 1,8 × 10 -17 |
| х | &прибл. | 4,24 × 10 -9 |
| рН | &прибл. | -log 10 [4,24 × 10 -9 ] |
| рН | &приблизительно; | 8,37 |
Очевидно, что полученный раствор не может содержать избыток OH — , который привел бы к pH > 7 (при 25°C), поэтому некоторые из сделанных нами предположений не оправдались.
Например, мы предположили, что диссоциирует очень мало CH 3 COOH ( x пренебрежимо мало по сравнению с концентрацией уксусной кислоты).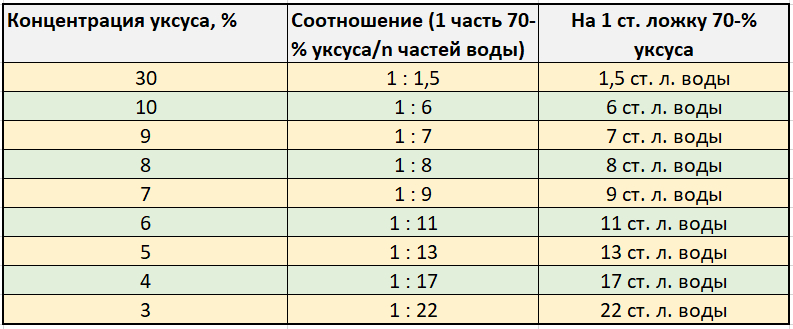
Но по мере того, как раствор становится все более разбавленным, % диссоциации увеличивается.
В какой-то момент мы уже не сможем не учитывать диссоциацию СН 3 СООН и значение х (определяемое путем решения квадратного уравнения) приблизится к концентрации кислоты (приближается к 100 % диссоциации)
Когда [CH 3 COOH (водн.) ] = 10 -6 моль л -1 , решение квадратного уравнения дает [H + (водн.) ] = 9,90 × 63 1 моль л -1 (около 95% диссоциации) и рН = 6, но если принять x можно не учитывать при расчете [CH 3 COOH (водн.) ], тогда [H + ] = 4,4 × 10 -6 и pH = 5,4
Когда [CH 3 COOH (водн.) ] = 10 -7 моль л -1 , решение квадратного уравнения дает [H + (водн.) ] = 10 90 6 6 моль л -1 (около 99,5% диссоциации) и pH = 7, но если принять x , можно не учитывать при расчете [CH 3 COOH (водн. ) ], тогда [H + ] = 1,34 × 10 -6 и pH = 5,9
) ], тогда [H + ] = 1,34 × 10 -6 и pH = 5,9
Но что произойдет, если мы продолжим разбавлять уксусную кислоту после этого момента? Каким будет рН 10 -12 моль л -1 уксусной кислоты?
Когда [CH 3 COOH (водн.) ] = 10 -12 моль л -1 мы замечаем, что концентрация уксусной кислоты на самом деле намного, намного меньше, чем концентрация ионов водорода в нейтральной воде!
| [CH 3 COOH (водный) ] | << | [H + (водн.) (водн.) ] |
| 10 -12 моль л -1 | << | 10 -7 моль л -1 |
Даже если бы все молекулы уксусной кислоты диссоциировали (100% диссоциация), максимальная концентрация ионов водорода в результате была бы 10 -12 моль л -1 , что много-много меньше вклада самодиссоциации воды в концентрацию ионов водорода в растворе.


 Убедитесь, что электрод погружен в раствор, и подождите несколько секунд, пока он не уравновесится.
Убедитесь, что электрод погружен в раствор, и подождите несколько секунд, пока он не уравновесится. Также запишите объем уксуса в Таблицу данных A1.
Также запишите объем уксуса в Таблицу данных A1.
 Не забудьте прочитать бюретку с точностью до 0,01 мл . Читать бюретку с такой точностью сложно; ожидается, что последняя значащая цифра будет оценочной.
Не забудьте прочитать бюретку с точностью до 0,01 мл . Читать бюретку с такой точностью сложно; ожидается, что последняя значащая цифра будет оценочной. Добавляйте титрант порциями ~1,0 мл, пока не будет добавлено в общей сложности ~11 мл титранта. Затем уменьшите количество добавляемого титранта с шагом ~0,5 мл или меньше. В этот момент pH должен измениться более чем на 0,3 единицы pH за одно добавление, сигнализируя о конечной точке титрования. Вы также увидите появление бледно-розового цвета, который быстро исчезнет. Когда окраска начнет исчезать медленнее, медленно добавляйте титрант до скорости по каплям. Промойте стенки стакана и кончик бюретки деионизированной водой из промывной бутылки по мере приближения к конечной точке. Это гарантирует, что весь NaOH, доставленный из бюретки, попадет в реакционную смесь. Конечная точка достигается, когда бледно-розовый цвет сохраняется не менее 30 секунд . Запишите показание точки эквивалентности на бюретке с точностью до 0,01 мл в таблице данных A1.
Добавляйте титрант порциями ~1,0 мл, пока не будет добавлено в общей сложности ~11 мл титранта. Затем уменьшите количество добавляемого титранта с шагом ~0,5 мл или меньше. В этот момент pH должен измениться более чем на 0,3 единицы pH за одно добавление, сигнализируя о конечной точке титрования. Вы также увидите появление бледно-розового цвета, который быстро исчезнет. Когда окраска начнет исчезать медленнее, медленно добавляйте титрант до скорости по каплям. Промойте стенки стакана и кончик бюретки деионизированной водой из промывной бутылки по мере приближения к конечной точке. Это гарантирует, что весь NaOH, доставленный из бюретки, попадет в реакционную смесь. Конечная точка достигается, когда бледно-розовый цвет сохраняется не менее 30 секунд . Запишите показание точки эквивалентности на бюретке с точностью до 0,01 мл в таблице данных A1. Не останавливайте титрование до тех пор, пока не будет добавлено примерно 5 мл титранта сверх точки эквивалентности.
Не останавливайте титрование до тех пор, пока не будет добавлено примерно 5 мл титранта сверх точки эквивалентности.
 Промойте стенки стакана и кончик бюретки деионизированной водой из промывной бутылки по мере приближения к конечной точке. Это гарантирует, что весь NaOH, доставленный из бюретки, попадет в реакционную смесь. Конечная точка достигается, когда бледно-розовый цвет сохраняется не менее 30 секунд. Запишите окончательное показание на бюретке с точностью до 0,01 мл в таблице данных A1.
Промойте стенки стакана и кончик бюретки деионизированной водой из промывной бутылки по мере приближения к конечной точке. Это гарантирует, что весь NaOH, доставленный из бюретки, попадет в реакционную смесь. Конечная точка достигается, когда бледно-розовый цвет сохраняется не менее 30 секунд. Запишите окончательное показание на бюретке с точностью до 0,01 мл в таблице данных A1.